Оплата и способы получения
Аналоги Семавик
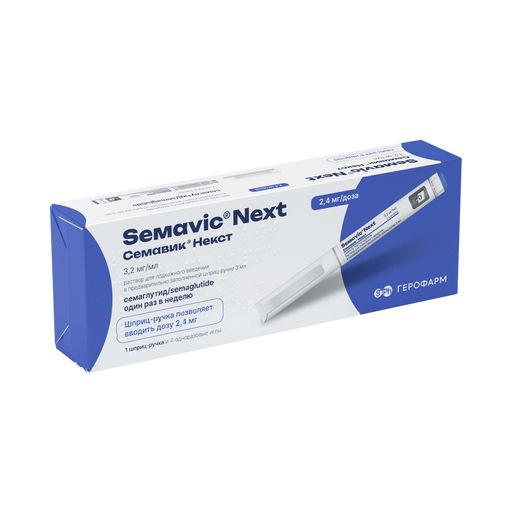
Инструкция на Семавик 1,34 мг/мл, раствор для подкожного введения, 3 мл, 1 шт.
Состав
1 мл раствора содержит: действующее вещество: семаглутид – 1,34 мг; вспомогательные вещества: динатрия rидрофосфат дигидрат – 1,42 мг, пропиленглколь – 14,0 мг, фенол – 5,5 мг, хлористоводородная кислота разведенная 10% и/или натрия гидроксида раствор 10% – для коррекции pH до 7,4, вода для инъекций – до 1 мл.
Описание
Прозрачный бесцветный или почти бесцветный раствор.
Фармакотерапевтическая группа
Гипогликемическое средство – аналог глюкагоноподобного пептида-1 (ГПП-1).
Фармакологическое действие
Семаглутид является агонистом рецепторов ГПП-1 (ГПП-1Р), произведенным химическим синтезом. Семаглутид представляет собой аналог ГПП-1, имеющий 94% гомологичности с человеческим ГПП-1. Семаглутид действует как агонист ГПП-1Р, который селективно связывается и активирует ГПП-1Р. ГПП-1Р служит мишенью для нативного ГПП-1. ГПП-1 является физиологическим гормоном, оказывающим сразу несколько эффектов на регуляцию концентрации глюкозы и аппетит, а также на сердечно-сосудистую систему (ССС). Влияние на концентрацию глюкозы и аппетит специфически опосредовано ГПП-1Р, расположенными в поджелудочной железе и головном мозге. Фармакологические концентрации семаглутида снижают концентрацию глюкозы крови и массу тела посредством сочетания эффектов, описанных ниже. ГПП-1Р представлены также в специфических областях сердца, сосудов, иммунной системы и почек, где их активация может оказывать сердечно-сосудистые (СС) и микроциркуляторные эффекты. В отличие от нативного ГПП-1, продлённый период полувыведения семаглутида (около 1 недели) позволяет применять его подкожно (п/к) 1 раз в неделю. Связывание с альбумином является основным механизмом длительного действия семаглутида, что приводит к снижению выведения его почками и защищает от метаболического распада. Кроме того, семаглутид стабилен в отношении расщепления ферментом дипептидилпептидазой-4. Семаглутид снижает концентрацию глюкозы крови посредством глюкозо-зависимых стимуляции секреции инсулина и подавления секреции глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка в ранней постпрандиальной фазе. Во время гипогликемии семаглутид уменьшает секрецию инсулина и не снижает секрецию глюкагона. Семаглутид снижает общую массу тела и массу жировой ткани, уменьшая потребление энергии. Данный механизм затрагивает общее снижение аппетита, включая усиление сигналов насыщения и ослабление сигналов голода, а также улучшение контроля потребления пищи и снижение тяги к пище. Снижается также инсулинорезистентность, возможно, за счёт уменьшения массы тела. Помимо этого, семаглутид снижает предпочтение к приёму пищи с высоким содержанием жиров. В исследованиях на животных было показано, что семаглутид поглощается специфическими областями головного мозга и усиливает ключевые сигналы насыщения и ослабляет ключевые сигналы голода. Воздействуя на изолированные участки тканей головного мозга семаглутид активирует нейроны, связанные с чувством сытости, и подавляет нейроны, связанные с чувством голода. В клинических исследованиях (КИ) семаглутид оказывал положительное влияние на липиды плазмы крови, снижал систолическое артериальное давление (АД) и уменьшал воспаление. В исследованиях на животных семаглутид подавляет развитие атеросклероза, предупреждая дальнейшее развитие аортальных бляшек и уменьшая воспаление в бляшках.
Фармакодинамика
Все фармакодинамические исследования были проведены после 12 недель терапии (включая период увеличения дозы) в равновесной концентрации семаглутида 1 мг 1 раз в неделю.
Уровень гликемии натощак и постпрандиальный уровень гликемии
Семаглутид снижает концентрацию глюкозы натощак и концентрацию постпрандиальной глюкозы. По сравнению с плацебо терапия семаглутидом 1 мг у пациентов с сахарным диабетом 2 типа (СД2) привела к снижению концентрации глюкозы с точки зрения абсолютного изменения от исходного значения (ммоль/л) и относительного снижения по сравнению с плацебо (%) в отношении: концентрации глюкозы натощак (1,6 ммоль/л; 22%); концентрации глюкозы через 2 часа после приёма пищи (4,1 ммоль/л; 37%); средней суточной концентрации глюкозы (1,7 ммоль/л; 22%) и постпрандиальных пиков концентрации глюкозы за 3 приёма пищи (0,6-1,1 ммоль/л). Семаглутид снижал концентрацию глюкозы натощак после введения первой дозы.
Функция бета-клеток поджелудочной железы и секреция инсулина
Семаглутид снижает концентрацию глюкозы натощак и концентрацию постпрандиальной глюкозы. По сравнению с плацебо терапия семаглутидом 1 мг у пациентов с сахарным диабетом 2 типа (СД2) привела к снижению концентрации глюкозы с точки зрения абсолютного изменения от исходного значения (ммоль/л) и относительного снижения по сравнению с плацебо (%) в отношении: концентрации глюкозы натощак (1,6 ммоль/л; 22%); концентрации глюкозы через 2 часа после приёма пищи (4,1 ммоль/л; 37%); средней суточной концентрации глюкозы (1,7 ммоль/л; 22%) и постпрандиальных пиков концентрации глюкозы за 3 приёма пищи (0,6-1,1 ммоль/л). Семаглутид снижал концентрацию глюкозы натощак после введения первой дозы.
Секреция глюкагона
Семаглутид снижает концентрацию глюкагона натощак и постпрандиальную концентрацию глюкагона. У пациентов с СД2 семаглутид приводит к относительному снижению концентрации глюкагона по сравнению с плацебо: концентрации глюкагона натощак (8-21%), постпрандиального глюкагонового ответа (14-15%) и средней суточной концентрации глюкагона (12%).
Глюкозозависимая секреция инсулина и глюкозозависимая секреция глюкагона
Семаглутид снижал высокую концентрацию глюкозы в крови, стимулируя секрецию инсулина и снижая секрецию глюкагона глюкозозависимым способом. Скорость секреции инсулина после введения семаглутида пациентам с СД2 была сопоставима с таковой у здоровых добровольцев. Во время индуцированной гипогликемии семаглутид по сравнению с плацебо не изменял контррегуляторный ответ повышения концентрации глюкагона, а также не усугублял снижение концентрации С-пептида у пациентов с СД2.
Опорожнение желудка
Семаглутид вызывал небольшую задержку раннего постпрандиального опорожнения желудка, тем самым снижая скорость поступления постпрандиальной глюкозы в кровь.
Масса тела и состав тела
Наблюдалось большее снижение массы тела при применении семаглутида по сравнению с изученными препаратами сравнения (плацебо, ситаглиптином, эксенатидом замедленного высвобождения (ЗВ), дулаглутидом и инсулином гларгин) (см. раздел «Клиническая эффективность и безопасность»). Потеря массы тела при применении семаглутида происходила преимущественно за счёт потери жировой ткани, превышающей потерю мышечной массы в 3 раза.
Аппетит, потребление калорий и выбор продуктов питания
По сравнению с плацебо семаглутид снизил потребление калорий на 18-35% во время трёх последовательных приёмов пищи ad libltum. Этому способствовали стимулированные семаглутидом подавление аппетита как натощак, так и после приёма пищи, улучшенный контроль потребления пищи, ослабление тяги к еде, особенно с высоким содержанием жиров.
Липиды натощак и постпрандиальные липиды
По сравнению с плацебо семаглутид снижал концентрации триглицеридов и холестерина липопротеинов очень низкой плотности (ЛПОНП) натощак на 12% и 21% соответственно. Постпрандиальное увеличение концентрации триглицеридов и холестерина ЛПОНП в ответ на приём пищи с высоким содержанием жиров снизилось более чем на 40%.
Электрофизиология сердца (ЭФС)
Действие семаглутида на процесс реполяризации в сердце было протестировано в исследовании ЭФС. Применение семаглутида в дозах, превышающих терапевтические (в равновесной концентрации до 1,5 мг), не приводило к удлинению скорректированного интервала QТ.
Фармакокинетика
Препарат подходит для введения l раз в неделю, так как период полувыведения семаглутида равен приблизительно 1 неделе.
Абсорбция
Время достижения максимальной концентрации (Cmax) в плазме составило от 1 до 3 дней после введения дозы препарата. Равновесная концентрация препарата (AUCt/24) достигалась спустя 4-5 недель однократного еженедельного применения препарата. После п/к введения семаглутида в дозах 0,5 мг и 1 мг средние показатели его равновесной концентрации у пациентов с СД2 составили около 16 нмоль/л и 30 нмоль/л соответственно. Экспозиция для доз семаглутида 0,5 мг и 1 мг увеличивается пропорционально введённой дозе. При п/к введении семаглутида в переднюю брюшную стенку, бедро или плечо достигается сходная экспозиция. Абсолютная биодоступность семаглутида после п/к введения составила 89%.
Распределение
Средний объём распределения семаглутида в тканях после п/к введения пациентам с СД2 составил приблизительно 12,5 л. Семаглутид в значительной степени связывался с альбумином плазмы крови (>99%).
Биотрансформация
Семаглутид метаболизируется посредством протеолитического расщепления пептидной основы белка и последующего бета-окисления жирной кислоты боковой цепи.
Элиминация
Желудочно-кишечный тракт (ЖКТ) и почки являются основными путями выведения семаглутида и его метаболитов. 2/3 введённой дозы семаглутида выводится почками, и 1/3 через кишечник. Приблизительно 3% от введённой дозы выводится почками в виде неизменённого семаглутида. У пациентов с СД2 клиренс семаглутида составил около 0,05 л/ч. С элиминационным периодом полувыведения примерно 1 неделя семаглутид будет присутствовать в общем кровотоке в течение приблизительно 5 недель после введения последней дозы препарата.
Особые группы пациентов
Не требуется коррекции дозы семаглутида в зависимости от возраста, пола, расовой и этнической принадлежности, массы тела, наличия почечной или печёночной недостаточности.
Возраст
На основании данных, полученных в ходе КИ За фазы, включавших пациентов в возрасте от 20 до 86 лет, показано, что возраст не влиял на фармакокинетику семаглутида.
Пол
Пол не влиял на фармакокинетику семаглутида.
Раса
Расовая группа (белая, чёрная или афроамериканская, азиатская) не влияла на фармакокинетику семаглутида.
Этническая принадлежность
Этническая принадлежность (латиноамериканская) не влияла на фармакокинетику семаглутида.
Масса тела
Масса тела влияла на экспозицию семаглутида. Более высокая масса тела приводит к более низкой экспозиции. Дозы семаглутида равные 0,5 мг и 1 мг обеспечивают достаточную экспозицию препарата в диапазоне массы тела от 40 до 198 кг.
Почечная недостаточность
Почечная недостаточность не оказала клинически значимого эффекта на фармакокинетику семаглутида. Это было показано у пациентов с различной степенью почечной недостаточности (лёгкой, средней, тяжёлой или у пациентов, находящихся на диализе) по сравнению с пациентами с нормальной функцией почек в исследовании однократной дозы семаглутида равной 0,5 мг. Это также было показано на основании данных КИ За фазы для пациентов с СД2 и почечной недостаточностью, хотя опыт применения у пациентов с терминальной стадией заболевания почек был ограничен.
Печёночная недостаточность
Печёночная недостаточность не влияла экспозицию семаглутида. Фармакокинетические свойства семаглутида оценивались в ходе исследований однократной дозы семаглутида равной 0,5 мг у пациентов с различной степенью печеночной недостаточности (лёгкой, средней, тяжёлой) по сравнению с пациентами с нормальной функцией печени.
Дети и подростки
Исследований семаглутида у детей и подростков до 18 лет не проводили.
Семавик: Показания
Препарат Семавик® показан для применения у взрослых пациентов с сахарным диабетом 2 типа на фоне диеты и физических упражнений для улучшения гликемического контроля в качестве:
- монотерапии
- комбинированной терапии с другими пероральными гипогликемическими препаратами (ПГГП) - у пациентов, не достигших адекватного гликемического контроля при проведении предшествующей терапии
- комбинированной терапии с инсулином у пациентов, не достигших адекватного гликемического контроля на терапии препаратом Семавик® и метформином
Препарат Семавик® показан для снижения риска развития больших сердечно-сосудистых событий* у пациентов с сахарным диабетом 2 типа и высоким сердечно-сосудистым риском в качестве дополнения к стандартному лечению сердечно-сосудистых заболеваний (на основании анализа времени наступления первого большого сердечно-сосудистого события – см. раздел «Фармакологические свойства», подраздел «Оценка влияния на ССС»).
*большие сердечно-сосудистые события включают: смерть по причине сердечнососудистой патологии, инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода.
Способ применения и дозы
Способ применения
Препарат Семавик® применяют 1 раз в неделю в любое время, независимо от приёма пищи. Препарат Семавик® вводят подкожно (п/к) в живот, бедро или плечо. Место инъекции может изменяться без коррекции дозы. Препарат Семавик® нельзя вводить внутривенно и внутримышечно. Информация по способу применения содержится в разделе «Руководство по использованию». При необходимости день еженедельного введения можно менять при условии, что интервал времени между двумя инекциями составляет не менее 3-х дней (>72 часов).
Дозы
Начальная доза препарата Семавик® составляет 0,25 мг 1 раз в неделю. После 4 недель применения дозу следует увеличить до 0,5 мг 1 раз в неделю. Для дальнейшего улучшения гликемического контроля после как минимум 4 недель применения препарата в дозе 0,5 мг 1 раз в неделю дозу можно увеличить до 1 мг 1 раз в неделю. Доза препарата Семавик® 0,25 мг не является терапевтической. Препарат Семавик® может применяться в виде монотерапии или в комбинации с одним или более гипогликемическими препаратами (см. раздел «Клиническая эффективность и безопасность»). При добавлении препарата Семавик® к предшествующей терапии метформином и/или тиазолидиндионом терапию метформином и/или тиазолидиндионом можно продолжить в прежних дозах. При добавлении препарата Семавик® к проводимой терапии производным сульфонилмочевины или инсулином следует предусмотреть снижение дозы производного сульфонилмочевины или инсулина с целью снижения риска возникновения гипогликемий (см. раздел «Особые указания»). Применение препарата Семавик® не требует проведения самоконтроля концентрации глюкозы крови. При применении препарата Семавик® в комбинации с производным сульфонилмочевины или инсулином такой самоконтроль концентрации глюкозы крови может потребоваться для коррекции дозы производного сульфонилмочевины или инсулина.
Пропущенная доза
В случае пропуска дозы препарат Семавик® следует ввести как можно быстрее в течение 5 дней с момента запланированного введения дозы. Если продолжительность пропуска составляет более 5 дней, пропущенную дозу не нужно вводить. Следующую дозу препарата Семавик® следует ввести в обычный запланированный день. В каждом случае пациенты могут возобновить их обычный однократный еженедельный график введения.
Применение препарата в особых клинических группах пациентов
Дети и подростки
Применение препарат Семавик® у детей в возрасте до 18 лет противопоказано в связи с отсутвием данных по эффективности и безопасности.
Пациенты пожилого возраста (≥ 65 лет)
Не требуется коррекции дозы в зависимости от возраста. Опыт применения семаглутида у пациентов в возрасте 75 лет и старше ограничен.
Пациенты с нарушением функции почек
Не требуется коррекции дозы у пациентов с почечной недостаточностью. Опыт применения препарата Семавик® у пациентов с терминальной стадией почечной недостаточности отсутствует; применение препарата Семавик® у таких пациентов противопоказано.
Пациенты с нарушением функции печени
Не требуется коррекции дозы у пациентов с печёночной недостаточностью (см. раздел «Фармакокинетика»). Опыт применения семаглутида у пациентов с печеночной недостаточностью тяжёлой степени ограничен; применение препарата Семавик® у таких пациентов противопоказано.
Применение при беременности и кормлении грудью
Беременность
Исследования на животных продемонстрировали репродуктивную токсичность препарата (см. раздел «Доклинические данные по безопасности»). Данные по применению семаглутида у беременных женщин ограничены. Противопоказано применять семаглутид во время беременности. Женщинам с сохранённым репродуктивным потенциалом рекомендуется использовать контрацепцию во время терапии семаглутидом. Если пациентка готовится к беременности, либо беременность уже наступила, терапию семаглутидом необходимо прекратить. Из-за длительного периода полувыведения терапию семаглутидом необходимо прекратить как минимум за 2 месяца до планируемого наступления беременности (см. раздел «Фармакокинетика»).
Период грудного вскармливания
У лактирующих крыс семаглутид проникал в молоко. Нельзя исключить риск для ребёнка, находящегося на грудном вскармливании. Противопоказано применять семаглутид в период грудного вскармливания.
Семавик: Противопоказания
- гиперчувствительность к семаглутиду или любому из вспомогательных веществ;
- медуллярный рак щитовидной железы в анамнезе, в том числе в семейном;
- множественная эндокринная неоплазия (МЭН) 2 типа;
- сахарный диабет 1 типа (СД1);
- диабетический кетоацидоз.
Противопоказано применение препарата Семавик® у следующих групп пациентов и при следующих состояниях/заболеваниях в связи отсутствием данных по эффективности и безопасности или ограниченным опытом применения:
- беременность и период грудного вскармливания;
- возраст до 18 лет;
- терминальная стадия почечной недостаточности (клиренс креатинина (КК) < 15 мл/мин);
- хроническая сердечная недостаточность (ХСН) IV функционального класса (в соответствии с классификацией NУНА (Нью-Йоркская кардиологическая ассоциация)).
С осторожностью
Препарат Семавик® рекомендуется применять с осторожностью у пациентов с почечной недостаточностью и у пациентов с наличием панкреатита в анамнезе (см. раздел «Особые указания»).
Семавик: Побочные действия
Наиболее часто регистрируемыми нежелательными реакциями (НР) во время КИ являлись нарушения со стороны ЖКТ, включая тошноту, диарею и рвоту. В целом, данные реакции были лёгкой или средней степени тяжести и краткосрочными. Нежелательные реакции, возможные при применении препарата Семавик®, распределены по системно-органным классам в соответствии со словарем для регуляторной деятельности MedDRA с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто: (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1 000, но <1/100), редко (≥1/10 000, но <1/1 000), очень редко (<1/10 000), частота неизвестна (на основании имеющихся данных оценить невозможно). В каждой группе частоты развития НР представлены по снижению степени серьёзности.
Таблица 1. Нежелательные реакции, выявленные при проведении КИ 3 фазы
| Система органов MedDRA | Очень часто | Часто | Нечасто | Редко |
|---|---|---|---|---|
| Нарушения со стороны иммунной системы | Анафилактические реакции | |||
| Нарушения со стороны обмена веществ и питания | Гипогликемия⁽ᵃ⁾ при совместном применении с инсулином или производным сульфонилмочевины | Гипогликемия⁽ᵃ⁾ при совместном применении с другими ПГГП Снижение аппетита | ||
| Нарушения со стороны нервной системы | Головокружение | Дизгевзия | ||
| Нарушения со стороны органа зрения | Осложнения диабетической ретинопатии⁽ᵇ⁾ | |||
| Нарушения со стороны сердца | Увеличение частоты сердечных сокращений (ЧСС) | |||
| Нарушения со стороны ЖКТ | Тошнота, диарея | Рвота, боль в животе, вздутие живота, запор, диспепсия, гастрит, гастроэзофагеальная рефлюксная болезнь, отрыжка, метеоризм | ||
| Нарушения со стороны печени и желчевыводящих путей | Холелитиаз | |||
| Общие расстройства и нарушения в месте введения | Утомляемость | Реакции в месте введения | ||
| Лабораторные и инструментальные данные | Повышение активности липазы, повышение активности амилазы, снижение массы тела |
⁽ᵃ⁾гипогликемия, определенная как тяжёлая (требующая помощи другого человека) или симптоматическая в сочетании с концентрацией глюкозы в плазме крови < 3,1 ммоль/л
⁽ᵇ⁾осложнения диабетической ретинопатии — это сочетание из: необходимости в фотокоагуляции сетчатки глаза, необходимости в интравитреальном введении препаратов, кровоизлияния в стекловидное тело, развития слепоты, связанной с СД
Частота основана на исследовании СС исходов.
Описание отдельных нежелательных реакций
Гипогликемия
Во время монотерапии препаратом Семавик® не наблюдалось эпизодов тяжёлой гипогликемии. Гипогликемия тяжёлой степени, в основном, наблюдалась при применении препарата Семавик® в комбинации с производным сульфонилмочевины или инсулином. Наблюдалось несколько эпизодов тяжёлой гипогликемии при применении препарата Семавик® в комбинации с другими, за исключением производного сульфонилмочевины, ПГГП.
НР со стороны ЖКТ
Во время терапии препаратом Семавик® в дозах 0,5 мг и 1 мг у пациентов отмечалась тошнота, диарея и рвота. Большинство реакций были от лёгкой до средней степени тяжести и краткосрочными. НР стали причиной преждевременного выбывания из КИ 3,9% и 5,9% пациентов соответственно. Чаще всего о НР сообщалось в первые месяцы терапии.
Осложнения диабетической ретинопатии
В 2-летнем КИ, в котором участвовали пациенты с СД2 и высоким СС риском, длительным течением СД и неадекватным контролем гликемии, подтверждённые случаи осложнений диабетической ретинопатии развивались у большего количества пациентов, получавших препарат Семавик® (3,0%), по сравнению с пациентами, получавшими плацебо (1,8%). У пациентов с анамнезом диабетической ретинопатии в начале КИ возрастание абсолютного риска развития осложнений было выше. У пациентов с отсутствием подтверждённого анамнеза диабетической ретинопатии количество событий было одинаковым при применении препарата Семавик® и плацебо. В КИ продолжительностью до 1 года частота НР, связанных с диабетической ретинопатией, была одинаковой в группе препарата Семавик® и препаратов сравнения.
Прекращение лечения по причине НР
Частота прекращения лечения по причине НР составила 8,7% для пациентов, получавших препарат Семавик® 1 мг. Наиболее частыми НР, приводившими к прекращению лечения, были нарушения со стороны ЖКТ.
Реакции в месте введения
Сообщалось о реакциях в месте введения (таких как сыпь в месте введения, покраснение) у 0,6% и 0,5% пациентов, получавших семаглутид 0,5 мг и 1 мг соответственно. Эти реакции носили, как правило, лёгкий характер.
Иммуногенность
Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов, у пациентов могут появиться антитела к семаглутиду после терапии препаратом Семавик®. В конце КИ доля пациентов, у которых были обнаружены антитела к семаглутиду в любой момент времени, была низкой (1-2%), и ни у одного пациента не было обнаружено нейтрализующих антител к семаглутиду или антител с нейтрализующим эндогенный ГПП-1 эффектом.
Если любые из указанных в инструкции нежелательных лекарственных реакций усугубляются или возникли любые другие нежелательные лекарственные реакции, не указанные в инструкции, необходимо сообщить об этом врачу.
Передозировка
Симптомы
В ходе КИ сообщалось о передозировках до 4 мг в однократной дозе и до 4 мг в неделю. Наиболее частой НР, о которой сообщалось, была тошнота. Все пациенты выздоровели без осложнений.
Лечение
Специфического антидота при передозировке препарата Семавик® не существует. В случае передозировки рекомендуется проведение соответствующей симптоматической терапии. Учитывая длительный период выведения препарата (примерно 1 неделя), может потребоваться продолжительный период наблюдения и лечения симптомов передозировки.
Взаимодействие
Фармакодинамическое взаимодействие
Исследования семаглутида in vitro показали очень небольшую вероятность ингибирования или индукции ферментов системы цитохрома Р450 (СУР) и ингибирования транспортёров лекарственных препаратов. Задержка опорожнения желудка при применении семаглутида может оказывать влияние на всасывание сопутствующих пероральных лекарственных препаратов.
Семаглутид следует применять с осторожностью у пациентов, получающих пероральные лекарственные препараты, для которых необходима быстрая абсорбция в ЖКТ.
Парацетамол
При оценке фармакокинетики парацетамола во время теста стандартизированного приёма пищи было выявлено, что семаглутид задерживает опорожнение желудка. При одновременном применении семаглутида в дозе 1 мг AUC0-60 мин и Cmax парацетамола снизились на 27% и 23% соответственно. Общая экспозиция парацетамола (AUC0-5 ч) при этом не изменялась. При одновременном приёме семаглутида и парацетамола коррекция дозы последнего не требуется.
Пероральные гормональные контрацептивные средства
Не предполагается, что семаглутид снижает эффективность пероральных гормональных контрацептивных средств. При одновременном применении комбинированного перорального гормонального контрацептивного препарата (0,03 мг этинилэстрадиола/0,15 мг левоноргестрела) и семаглутида последний не оказывал клинически значимого влияния на общую экспозицию этинилэстрадиола и левоноргестрела. Экспозиция этинилэстрадиола не была затронута; наблюдалось увеличение на 20% экспозиции левоноргестрела в равновесном состоянии. Cmax не изменилась ни для одного из компонентов.
Аторвастатин
Семаглутид не изменял системную экспозицию аторвастатина после применения однократной дозы аторвастатина (40 мг). Cmax аторвастатина снизилась на 38%. Это изменение было расценено как клинически незначимое.
Дигоксин
Семаглутид не изменял системную экспозицию или Cmax дигоксина после применения однократной дозы дигоксина (0,5 мг).
Метформин
Семаглутид не изменял системную экспозицию или Cmax метформина после применения метформина в дозе 500 мг 2 раза в день в течение 3,5 дней.
Варфарин
Семаглутид не изменял системную экспозицию или Cmax R- и S-изомеров варфарина после применения однократной дозы варфарина (25 мг). На основании определения международного нормализованного отношения (МНО) клинически значимых изменений фармакодинамических эффектов варфарина также не наблюдалось.
Несовместимость
Препарат Семавик® нельзя смешивать с другими лекарственными средствами, в том числе с инфузионными растворами. Вещества, добавленные к препарату Семавик®, могут вызвать деградацию семаглутида.
Особые указания
Применение препарата Семавик® противопоказано у пациентов с СД1 или для лечения диабетического кетоацидоза. Препарат Семавик® не заменяет инсулин
Реакции со стороны ЖКТ
Применение агонистов ГПП-1Р может быть ассоциировано с НР со стороны ЖКТ. Это следует учитывать при лечении пациентов с почечной недостаточностью, так как тошнота, рвота и диарея могут привести к дегидратации и ухудшению функции почек.
Острый панкреатит
При применении агонистов ГПП-1Р наблюдались случаи развития острого панкреатита. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. При подозрении на панкреатит терапия препаратом Семавик® должна быть прекращена; в случае подтверждения острого панкреатита терапию препаратом Семавик® возобновлять не следует. Следует соблюдать осторожность у пациентов с панкреатитом в анамнезе. При отсутствии других признаков и симптомов острого панкреатита повышение активности ферментов поджелудочной железы не является прогностическим фактором развития острого панкреатита.
Гипогликемия
Пациенты, получающие препарат Семавик® в комбинации с производными сульфонилмочевины или инсулином, могут иметь повышенный риск развития гипогликемии. В начале лечения препаратом Семавик® риск развития гипогликемии можно снизить, уменьшив дозу производного сульфонилмочевины или инсулина.
Диабетическая ретинопатия
Наблюдалось повышение риска развития осложнений диабетической ретинопатии у пациентов с наличием диабетической ретинопатии, получающих терапию инсулином и семаглутидом (см. раздел «Побочное действие»). Следует соблюдать осторожность при применении семаглутида у пациентов с диабетической ретинопатией, получающих инсулинотерапию. Такие пациенты должны находиться под постоянным наблюдением и получать лечение в соответствии с клиническими рекомендациями. Быстрое улучшение гликемического контроля было ассоциировано с временным ухудшением состояния диабетической ретинопатии, однако при этом нельзя исключать и другие причины.
Сердечная недостаточность
Отсутствует опыт применения препарата Семавик® у пациентов с ХСН IV функционального класса в соответствии с классификацией NYНА. Применение препарата у таких пациентов противопоказано.
Заболевания щитовидной железы
В пострегистрационном периоде применения другого аналога ГПП-1, лираглутида, были отмечены случаи медуллярного рака щитовидной железы (МРЩЖ). Имеющихся данных недостаточно для установления или исключения причинно-следственной связи возникновения МРЩЖ с применением аналогов ГПП-1. Необходимо проинформировать пациента о риске МРЩЖ и о симптомах опухоли щитовидной железы (появления уплотнения в области шеи, дисфагии, одышки, непроходящей охриплости голоса). Значительное повышение концентрации кальцитонина в плазме крови может указать на МРЖЩ (у пациентов с МРЖЩ значения концентрации кальцитонина в плазме крови обычно >50 нг/л). При выявлении повышения концентрации кальцитонина в плазме крови следует провести дальнейшее обследование пациента. Пациенты с узлами в щитовидной железе, выявленными при медицинском осмотре или при проведении УЗИ щитовидной железы, также должны быть дополнительно обследованы. Применение семаглутида у пациентов с личным или семейным анамнезом МРЩЖ или с синдромом МЭН типа 2 противопоказано.
Доклинические данные безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека. В 2-летних исследованиях канцерогенности у крыс и мышей при клинически значимых концентрациях семаглутид стал причиной развития опухолей С-клеток щитовидной железы без смертельного исхода. Опухоли С-клеток щитовидной железы без смертельного исхода, наблюдаемые у крыс, характерны для группы аналогов ГПП-1. Считается, что в отношении людей данный риск является низким, но не может быть полностью исключён.
Фертильность
Действие семаглутида на фертильность у людей неизвестно. Семаглутид не влиял на фертильность самцов крыс. Среди самок крыс увеличение эстрального цикла и незначительное снижение количества овуляций наблюдалось при дозах, сопровождавшихся снижением массы тела самки.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Семавик® не влияет или незначительно влияет на способность управлять транспортными средствами или работу с механизмами. Пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортными средствами и при работе с механизмами, особенно при применении препарата Семавик® в комбинации с производным сульфонилмочевины или инсулином.
Форма выпуска
Раствор для подкожного введения, 1,34 мг/мл. По 3 мл препарата в картриджи бесцветные нейтрального стекла с плунжерами резиновыми, обкатанные комбинированными колпачками из алюминия с дисками резиновыми. Картридж устанавливают в пластиковую мультидозовую одноразовую шприц-ручку для многократных инъекций. На корпус каждой шприц-ручки наклеивают этикетку из пленки полипропиленовой. По 1 предварительно заполненной мультидозовой одноразовой шприц-ручке для многократных инъекций и 4 одноразовых иглы с инструкцией по медицинскому применению лекарственного препарата и инструкцией по использованию шприц-ручки помещают в пачку из картона.
Условия хранения
Хранить при температуре от 2 °С до 8 °С (в холодильнике), но не рядом с морозильной камерой. Защищать от света. Не замораживать. Используемую или переносимую в качестве запасной шприц-ручку с препаратом хранить при температуре не выше 30 °С или при температуре от 2 °С до 8 °С (в холодильнике) в течение 6 недель. Не замораживать. После использования закрывать шприц-ручку колпачком для защиты от света. Препарат Семавик® следует предохранять от воздействия избыточного тепла и света. Хранить в недоступном для детей месте.
Срок годности
2 года. Не применять по истечении срока, указанного на этикетке шприц-ручки и упаковке.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
ООО «ГЕРОФАРМ», Российская Федерация 191119, г. Санкт-Петербург, ул. Звенигородская, д. 9 Телефон: (812) 703-79-75 (многоканальный), факс: (812) 703-79-76
Производитель
ООО «ГЕРОФАРМ», Российская Федерация
Все стадии производственного процесса:
1. 142279, Россия, Московская область, городской округ Серпухов, рабочий поселок Оболенск, территория «Квартал А», стр. 5, корп. 1
2. 142279, Россия, Московская область, городской округ Серпухов, рабочий поселок Оболенск, территория «Квартал А», стр. 4, корп. 82
Организация, принимающая претензии потребителей
Российская Федерация ООО «ГЕРОФАРМ» 196608, г. Санкт-Петербург, г. Пушкин, Ячевский проезд, д.4, стр.1
Телефон: +7 (812) 493-55-01 Факс: +7 (812) 493-55-69
Телефон горячей линии: 8-800-333-4376 (звонок по России бесплатный)
Веб-сайт: www.geropharm.ru
Информацию о нежелательных реакциях просим направлять на электронный адрес inform@geropharm.ru; farmakonadzor@geropharm.com или по указанным выше контактам ООО «ГЕРОФАРМ».
Характеристики
Цены в аптеках на Семавик 1,34 мг/мл, раствор для подкожного введения, 3 мл, 1 шт.


История стоимости Семавик 1,34 мг/мл, раствор для подкожного введения, 3 мл, 1 шт.
Цены Семавик и наличие в аптеках в Южно-Сахалинске
Отзывы о Семавик
Дистанционная торговля лекарственными препаратами осуществляется исключительно аптечными организациями, имеющими действующую лицензию на фармацевтическую деятельность, а также разрешение на дистанционную торговлю лекарственными препаратами. Дистанционная торговля рецептурными лекарственными препаратами, наркотическими и психотропными, а также спиртосодержащими лекарственными препаратами запрещена действующим законодательством РФ и не осуществляется.
На информационном ресурсе применяются рекомендательные технологии .